A introdução da cirurgia conhecida como Vitrectomia Via Pars Plana (VVPP) (cirurgia de retina e vítreo) no início da década de 1970 pelo Dr. Robert Machemer contava com um sistema de esclerotomias de calibre 17 gauge (1,14 mm) e uma taxa de corte inferior a 400 cortes por minuto (cpm), sendo considerada como um avanço importante no tratamento cirúrgico de doenças vitreorretinianas.[1] Pela primeira vez, pacientes com hemorragia vítrea densa podiam ter alguma melhora visual. Casos de descolamento de retina já não dependiam apenas da retinopexia com introflexão escleral, técnica com reconhecidas limitações em casos complexos. Complicações de cirurgia de catarata, opacidades vítreas densas, doenças da mácula como membrana epirretiniana e buraco macular, uma gama de condições oculares se tornaram passíveis de tratamento. No entanto, a cirurgia vitreorretiniana evoluiu muito a partir desse momento, reduzindo drasticamente a taxa de complicações e tempo cirúrgico. Em primeiro lugar, por melhorias tecnológicas nos aparelhos de vitrectomia: sistema de três portas, melhor controle de fluidos, taxas de corte mais rápidas, melhores fontes de luz e calibres de incisão menores.[2] Em segundo lugar, novas técnicas, dispositivos e materiais como: troca fluido-gasosa automatizada, endolaser, endodiatermia, tamponantes internos e corantes. O advento da vitrectomia de calibre 23 e 25 gauge tornou possível a cirurgia sem sutura. Melhorias nos sistemas de visualização e processamento de software de imagem digital garantiram uma boa visualização em situações difíceis.[3]
Melhorias nos aparelhos de vitrectomia
A sonda principal de vitrectomia é o instrumento responsável por cortar o vítreo em pequenas porções e aspirá-lo exercendo o mínimo de tração possível. No sistema convencional, pulsos pneumáticos empurram o cortador para uma direção, e o recuo passivo de uma mola retorna a lâmina à sua posição original. Os sistemas da geração atual podem atingir 5.000-7.500 cpm com grande eficiência, mas acima disso pode-se observar queda na eficiência de vitrectomia. Atualmente, existem duas estratégias para melhorar essa limitação. Um mecanismo de corte duplo-pneumático usa linhas de ar separadas para controlar a abertura e o fechamento do cortador. A outra estratégia é usar uma abordagem de cortador bidimensional na qual uma lâmina de dupla lateral corta tanto nas direções para a frente quanto para trás para alcançar uma taxa de corte efetiva de até 20.000 cpm com ciclo de trabalho mais alto.[4] Estudos comparando essas duas estratégias com a técnica tradicional demonstraram diminuição significativa no tempo de vitrectomia em 34-50%.[4,5] Recentemente, um novo mecanismo usando ultrassom para liquefazer o vítreo foi desenvolvido, com a vantagem potencial de criar quase nenhuma tração durante a vitrectomia.[6]
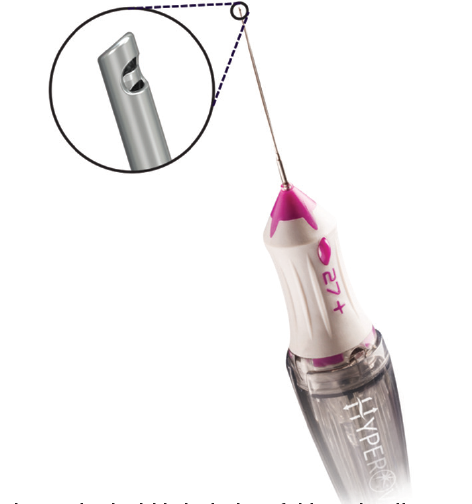
Figura 1. O design de lâmina dupla desta sonda permite altas taxas de corte (até 20.000 cpm) com aspiração vítrea constante, reduzindo a tração vítrea durante a vitrectomia. Fonte: Karth PA. The beauty of a dual-blade vitrectomy probe. Retina Today Jan/Feb 2020.
Novos sistemas de iluminação e visualização
A endoiluminação utiliza uma fibra óptica inserida na cavidade vítrea através de uma das portas de vitrectomia, inicialmente utilizando fontes de halogênio, vapor de mercúrio e lâmpada de halide metálico.[7] Posteriormente surgiram as fontes de luz xenônio ou diodo emissor de luz (LED), com maior eficiência de iluminação. Ambos têm luminância significativa através de sondas de pequeno calibre e vida útil consideravelmente maior. Com o aumento da iluminação e distribuição espectral, foram levantadas preocupações sobre possível fototoxicidade da retina com fontes de luz xenônio com comprimento de onda < 450 nm. Por essa razão, a maioria dos fabricantes incorporou filtros para bloquear a luz azul e ultravioleta mais tóxicas à retina. As fontes de luz LED parecem ser menos fototóxicas em modelos animais na mesma intensidade.[8]
O sistema de iluminação tipo “chandelier” é uma endoilluminação estacionária e grande angular desenvolvida para cirurgia de retina (disponíveis na forma de sondas únicas ou duplas com calibre de 23 a 29 gauge). Permite que o cirurgião use a segunda mão para manipulações cirúrgicas bimanuais e melhora as condições de iluminação em casos de maior complexidade, produzindo também ótimas imagens para documentação e vídeos cirúrgicos. Ainda em relação à visualização, houve uma grande evolução nos sistemas de grande angular, que existem em duas formas principais. No tipo de contato, a lente é colocada sobre a córnea, com interposição de viscoelástico e precisa ser fixada por algum dispositivo ou apoiada por um assistente durante a cirurgia. No tipo de não-contato, o sistema de lentes é colocado acima da córnea, conferindo maior praticidade e independência ao cirurgião. Há também um inversor prismático que é montado no microscópio ou no próprio sistema de lentes para inverter a visão do fundo do olho.
Os sistemas de visualização de grande angular aumentam a segurança e a proficiência das cirurgias vitreorretinianas, proporcionando uma visão panorâmica da retina em todas as etapas da cirurgia, inclusive no acesso à base vítrea, com ou sem indentação escleral.[9] O fino ajuste de foco e zoom dos microscópios e sistemas de visualização modernos permitem manobras cirúrgicas até então impraticáveis.

Figura 2. Sistema de visualização grande angular de não-contato com ajuste de zoom/foco e inversor automatizados. Fonte: catálogo de produtos Oculus BIOM®
Redução dos calibres incisionais (small-gauge) e trocartes valvulados
Nas últimas duas décadas, seguindo os avanços na cirurgia de facoemulsificação, obtivemos uma redução progressiva no tamanho da incisão escleral (esclerotomia) de 20 para 23 gauge, realizada de forma transconjuntival, e mais recentemente, para 25 e 27 gauge.[10] Os calibres menores tiveram algumas desvantagens no início: instrumentos muito flexíveis, sondas de endoiluminação eram fracas, e a velocidade de remoção vítrea era lenta. Melhorias técnicas, muitas já discutidas neste artigo, logo eliminaram em grande parte esses problemas. Uma ampla gama de diferentes instrumentos microcirúrgicos mais rígidos foi projetada para sistemas de vitrectomia de calibre 23 e 25, como cortadores vítreos, trocartes, sondas de iluminação e endolaser, pinças, cânulas, tesouras etc.[11] Outra vantagem das microincisões, quando realizadas com a técnica adequada de “tunelização” ou inserção oblíqua, é reduzir ou praticamente eliminar a necessidade de suturas ao final da cirurgia (“sutureless surgery”), melhorando significativamente o conforto do paciente no pós-operatório.
A introdução recente dos sistemas de vitrectomia de calibre 25 e 27 tem alguns benefícios em termos de técnica cirúrgica. A abertura de corte dessas sondas está mais próxima da extremidade distal da ponta, o que dá acesso a planos de tecido mais profundos durante a dissecção de membranas epirretinianas, como em membranas tracionais diabéticas. Combinada com as melhorias nas técnicas cirúrgicas e melhor visualização com sistemas de grande angular, a sonda de vitrectomia pode ser usada como pinça, tesoura e espátula de delaminação quando necessário, sem saída do olho. Quando uma abordagem bimanual é necessária, uma sonda chandelier geralmente fornece uma quantidade ideal de luz, até mesmo nos calibres menores.[11]
Sistemas de trocartes valvulados permitem fluídica de sistema fechado, impedindo o refluxo de fluido intraocular durante a cirurgia. Isto traz várias vantagens como o controle e monitoramento da pressão intraocular, menor turbulência na cavidade vítrea com potencial para redução do encarceramento retiniano, roturas iatrogênicas e dispersão indesejada de materiais na cavidade vítrea, como perfluorocarbono.[12]

Figura 3. Ponteiras de vitrectomia com calibres progressivamente menores mantém a eficiência da remoção do vítreo com menos complicações e maior versatilidade. Fonte: Lakhanpal RR, Bonin JE. Fifteen years of minimally invasive vitreoretinal surgery. Retina Today Jan/Feb 2018.
Substâncias usadas na cavidade vítrea (tamponantes, corantes)
No que diz respeito à cirurgia vitreorretiniana, os agentes de tamponamento são utilizados para promover tensão superficial sobre as rupturas da retina, prevenindo o influxo de líquido no espaço sub-retiniano até que a retinopexia (fotocoagulação ou criopexia) promova aderência coriorretiniana definitiva. Gases como o SF6 e C3F8 e óleos de silicone são as classes mais utilizadas de agentes tamponantes, e possibilitam a correção cirúrgica de descolamentos de retina complexos e buracos maculares. Além da disponibilidade de diferentes viscosidades do óleo de silicone (1000 e 5000 centistokes), também está disponível óleo de silicone pesado, mais denso do que a água, que pode ser usado para tamponar a retina inferior. Deve-se ressaltar, no entanto, a reconhecida toxicidade do óleo de silicone e sua propensão em induzir glaucomas secundários.[13]
Os líquidos perfluorocarbonos (PFC) são uma importante contribuição feita por Stanley Chang para a cirurgia vitreorretiniana. Estes líquidos pesados são usados no intraoperatório para facilitar vários procedimentos, como inverter o retalho de ruptura de retina gigante, realizar retinectomias relaxantes, deslocamento de fluidos subretinianos e sangue, “levitar” lente intraocular deslocada ou fragmentos cristlinianos e estabilização do polo posterior para dissecção periférica. Os líquidos PFC são usados principalmente como agentes intraoperatórios e às vezes usados a longo prazo, apesar de sua toxicidade à retina.[14] O óleo de silicone ainda é o melhor agente de tamponamento de longo prazo disponível, embora a busca esteja acontecendo por um substituto melhor.[15]
O uso de corantes vitais permite a identificação mais fácil do vítreo e membranas pré-retinianas semitransparentes. As recomendações atuais indicam que o azul brilhante parece ser o melhor corante para a membrana limitante interna, com excelente perfil de segurança, enquanto o azul trypan é utilizado para a coloração dos tecidos gliais como a membrana epirretiniana. [16] Acetonido de triancinolona é utilizado com frequência para identificação do vítreo e facilitar a indução do descolamento do vítreo posterior. Pesquisas recentes da Unifesp tentam viabilizar o corante à base das antocianinas do açaí como uma alternativa viável, de fabricação 100% nacional.[17]
? Aproveite para ler: Fique de olho: confira 11 Congressos de Oftalmologia em 2023
Cirurgia vitreorretiniana digitalmente assistida (“Heads-up surgery”)
Desenvolvimentos recentes na cirurgia vitreorretiniana digitalmente assistida (DAVS) também estão ganhando popularidade. Câmeras de alto alcance dinâmico 3D montadas no lugar das oculares do microscópio, que estão conectadas a uma unidade central de processamento, finalmente projetam a imagem cirúrgica ao vivo numa tela grande de alta resolução. As vantagens relatadas deste sistema incluem alta ampliação; ergonomia melhorada para o cirurgião; uma diminuição na endoiluminação necessária através de um processamento aprimorado de sinal digital; melhor profundidade de foco com campo amplo; capacidade de sobrepor estudos diagnósticos, incluindo dados de OCT intraoperatórios; e capacidades aprimoradas de ensino e documentação.[18]
A ergonomia melhorada é a vantagem mais importante deste sistema. Sem a necessidade de se inclinar para a frente e olhar para as oculares do microscópio, o cirurgião pode sentar-se na cadeira e usar o encosto para apoio nas costas. Essa configuração pode reduzir as tensões nas costas e pescoço, especialmente para cirurgias longas em casos complicados. A qualidade da imagem depende de condições específicas, como distância do display do cirurgião, ângulo do display em relação ao cirurgião e minimização do brilho. O posicionamento do monitor deve ser o mais reto possível para alcançar a qualidade ideal da imagem. Como um assistente senta-se perpendicular à cabeça do paciente, há a necessidade de uma virada de cabeça em direção à tela, o que pode exigir mais tempo para o assistente se adaptar.[19]
Com a cirurgia exibida na tela, qualquer um na sala usando óculos 3D é capaz de ver os detalhes da cirurgia. Isso proporciona um importante benefício educacional, permitindo que os estagiários observem exatamente o que o cirurgião está fazendo.
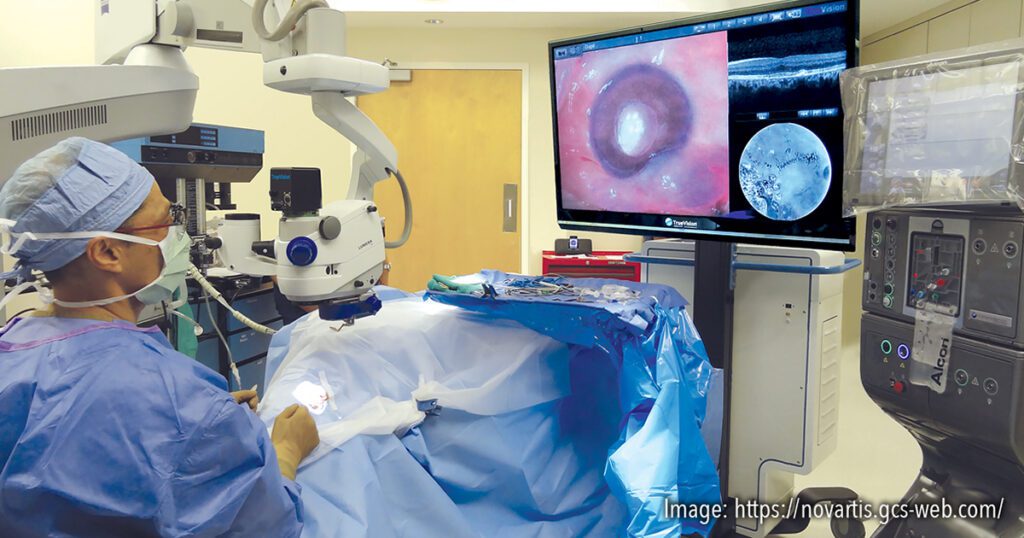
Figura 4. Plataforma de cirurgia vitreorretiniana digitalmente assistida (DAVS) permite ao cirurgião operar olhando direto para uma tela de alta resolução com óculos 3D, ao invés de olhar pelas oculares do microscópio. Fonte: imagem cortesia da Alcon/Novartis.
Conclusão
Os novos desenvolvimentos em instrumentos cirúrgicos, máquinas, trocartes, sistemas de visualização e técnicas cirúrgicas desempenharam papel significativo na diminuição de complicações e na melhoria dos resultados das cirurgias vitreorretinianas modernas. Ainda há alguns problemas para resolver, como encontrar um tamponante vítreo com menor toxicidade que o óleo de silicone. Também drogas melhores precisavam ser descobertas para evitar vitreorretinopatia proliferativa e hipotonia. Além disso, há novas conquistas em terapias com células-tronco, terapia gênica, implantes artificiais de retina e sistemas de visualização avançados como a vitrectomia endoscópica. O progresso na área de cirurgia vitreorretiniana está em curso mais rápido do que nunca. Em um futuro próximo, a cirurgia será uma opção para uma variedade de diferentes patologias, incluindo casos que classificamos como inoperáveis hoje.
REFERÊNCIAS
1. Machemer R, Norton E. Vitrectomy, a pars plana approach II. Clinical experience. Modern Problems in Ophthalmology. 1972;10:178-185
2. Charles S. The history of vitrectomy: Innovation and evolution. Retina Today. 2008;4:27-9
3. Chaves de Oliveira PR, Berger AR, Chow DR. Vitreoretinal instruments: Vitrectomy cutters, endoillumination and wide-angle viewing systems. Int J Retina Vitreous. 2016;2:28
4. Mariotti C, Nicolai M, Saitta A, Orsini E, Viti F, Skrami E, et al. Standard cut rate 25-gauge vitrectomy versus ultrahigh-speed 25-gauge system in core vitrectomy: A randomized clinical trial. Retina. 2016;36:127104
5. Pavlidis M. Two-dimensional cutting (TDC) vitrectome: In vivo flow assessment and prospective clinical study evaluating core vitrectomy efficiency versus standard vitrectome. J Ophthalmol. 2016;2016:3849316
6. Stanga PE, Pastor S, Zambrano I, Carlin P. New prototype of ultrasound harmonics vitrector (UHV) fluidics analysis: First report. Invest Ophthalmol Vis Sci. 2015;56:385
7. Sakaguchi H, Oshima Y. Considering the illumination choices in vitreoretinal surgery. Retinal Physician. 2012;9:26-31
8. Aydin B, Dinç E, Yilmaz SN, Altiparmak UE, Yülek F, Ertekin S, et al. Retinal endoilluminator toxicity of xenon and light-emitting diode (LED) light source: Rabbit model. Cutan Ocul Toxicol. 2014;33:192-6
9. Kadonosono K. Achieving wide angle view during vitrectomy. Retina Today. 2011;6:43-5
10. Chang S. Transitioning to microincisional vitrectomy surgery. Retina Today. 2008;4:5-6
11. Fujii GY, De Juan E Jr, Humayun MS, Pieramici DJ, Chang TS, Awh C, et al. A new 25-gauge instrument system for transconjunctival sutureless vitrectomy surgery. Ophthalmology. 2002;109:1807-12
12. Abulon D, Charles M. The impact of valved and non-valved cannula on intraoperative fluid dynamics and vitreous. In: 14th Euretina Congress; September 11-14. London; 2014
13. Pichi F, Hay S, Abboud EB. Inner retinal toxicity due to silicone oil: a case series and review of the literature. Int Ophthalmol. 2020 Sep;40(9):2413-22.
14. Coll GE, Chang S, Sun J, Wieland MR, Berrocal MH. Perfluorocarbon liquid in the management of retinal detachment with proliferative vitreoretinopathy. Ophthalmology. 1995;102:630-638
15. Wang T, Ran R, Ma Y, Zhang M. Polymeric hydrogel as a vitreous substitute: current research, challenges, and future directions. Biomed Mater. 2021 Jun 11;16(4).
16. Penha FM, Pons M, Costa Ede P, Rodrigues EB, Maia M, Marin-Castaño ME, et al. Effect of vital dyes on retinal pigmented epithelial cell viability and apoptosis: Implications for chromovitrectomy. Ophthalmologica. 2013;230:41-50
17. Caiado RR, Peris C, Rodrigues EB, Farah ME, Maia A, Magalhães O Jr, Novais E, Lima-Filho AS, Maia M. A new dye based on anthocyanins from the acai fruit (Euterpe oleracea) for chromovitrectomy in humans: clinical trial results. Graefes Arch Clin Exp Ophthalmol. 2019 Mar;257(3):517-28.
18. Eckardt C, Paulo EB. Heads-up surgery for vitreoretinal procedures: An experimental and clinical study. Retina. 2016;36:137-147
19. Palácios RM, Maia de Carvalho AC, Maia M et al. An experimental and clinical study on the initial experiences of Brazilian vitreoretinal surgeons with heads-up surgery. Graefes Arch Clin Exp Ophthalmol 257(3):473-83.